W jakich przypadkach obowiązuje UDI? Sprawdź szczegółową klasyfikację producentów
Na terenie Unii Europejskiej, podobnie jak już to się dzieje w Stanach Zjednoczonych, będą obowiązywać przepisy dotyczące tzw. UDI. Chodzi o Unikalną Identyfikację Wyrobów Medycznych. W praktyce: wszystkie tego typu rzeczy będą specjalnie znakowane – zarówno na etykietach, jak i opakowaniach.
Zasady i terminy obowiązywania poszczególnych wymogów, dotyczących UDI, podała Komisja Europejska. Szczegółowe informacje na ten temat znajdują się poniżej.
Podział producentów na klasy
UDI, czyli system służący do oznaczania i identyfikacji urządzeń medycznych w łańcuchu dostaw opieki zdrowotnej, jest zróżnicowany pod kątem klas poszczególnych wyrobów. Co ważne, jest ujednolicony w wymiarze globalnym. Kwestia te jest regulowana przez Rozporządzenie Parlamentu Europejskiego i Rady Unii Europejskiej z 5 kwietnia 2017 roku.
Zgodnie z międzynarodową praktyką, wyroby medyczne zostały podzielone na cztery klasy produktów. Klasyfikacja ta jest oparta na kryterium narażenia ciała ludzkiego (uwzględnia potencjalne ryzyko związane z projektem technicznym i produkcją wspomnianych wyrobów). Jest dokonywana przy uwzględnieniu kilku czynników – stopnia inwazyjności, czasu i rodzaju styczności z pacjentem, sposobu zasilania, a także obecności składników potencjalnie niebezpiecznych dla pacjenta.
Klasyfikacja producentów
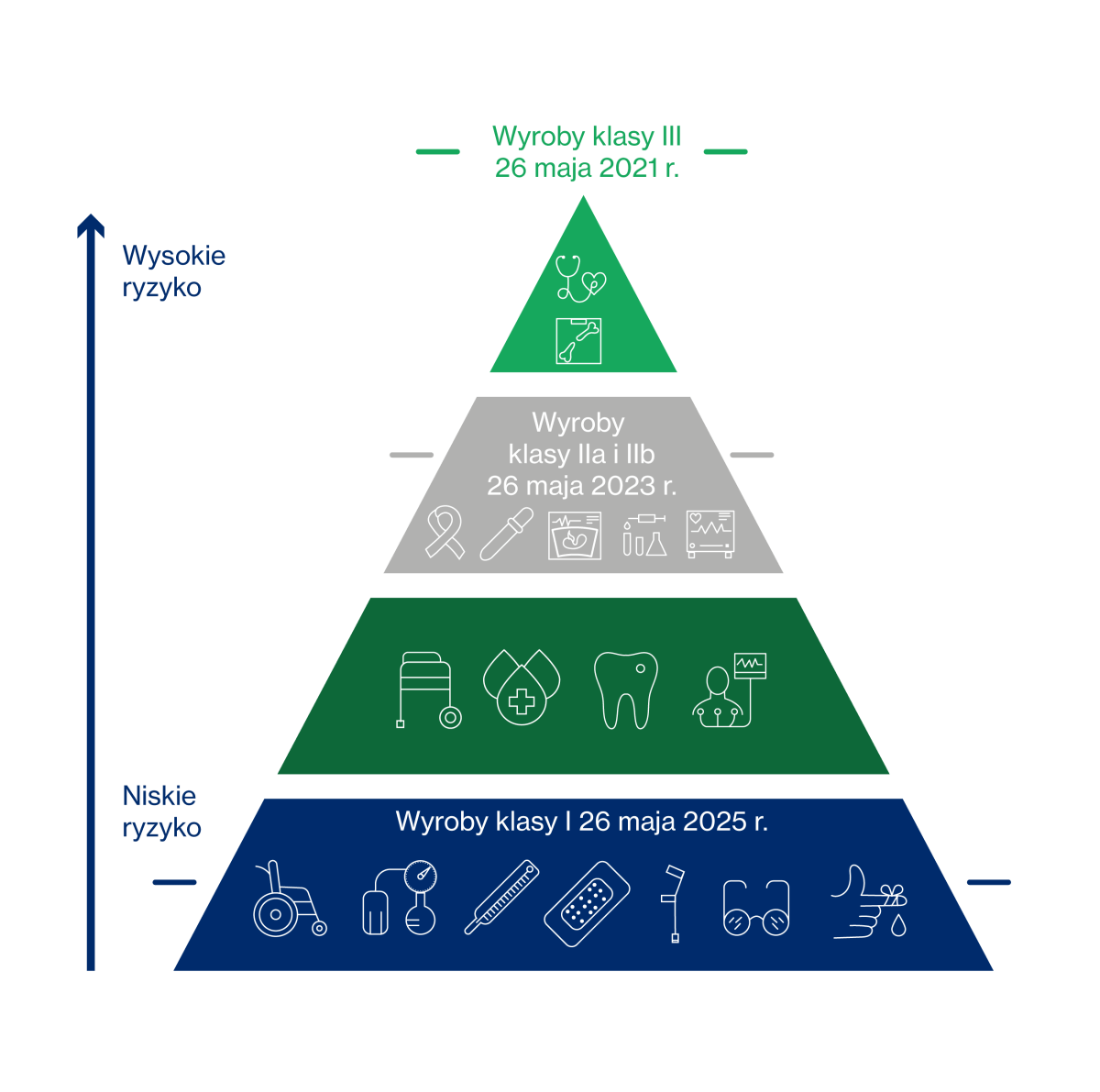
Zgodnie z art. 51 wyżej wymienionego Rozporządzenia, wyroby dzieli się na klasy I, IIa, IIb oraz III. Sama klasyfikacja jest istotna szczególnie dla ich producentów, bo właśnie od niej zależy rodzaj dalszej procedury. Zasada jest prosta: im wyższa jest klasa wyrobu, tym bardziej restrykcyjna jest procedura oceny zgodności.
Do wyrobów medycznych klasy I (najniższego ryzyka) zaliczane są na przykład kołnierze ortopedyczne, rękawice do badań, wózki inwalidzkie, bandaże elastyczne, nić dentystyczna, wyroby z funkcją pomiarową, wyroby sterylne.
Do wyrobów klasy IIa można zaliczyć na przykład opatrunki hydrożelowe, cewniki jednorazowe oraz klisze rentgenowskie. Natomiast do klasy IIb – pojemniki na krew, prezerwatywy czy respiratory.
Z kolei do wyrobów klasy III (najwyższego ryzyka) klasyfikowane są na przykład implanty piersi, zastawki serca, protezy naczyniowe, implanty ślimakowe, baterie do rozruszników serca.
Podział wyrobów medycznych na klasy – od kiedy?
Obowiązek zamieszczania na medycznych etykietach i opakowaniach specjalnych kodów zacznie obowiązywać od 26 maja 2021 roku (przynajmniej dla niektórych wyrobów). Właśnie ten termin jest wskazany w przypadku wyrobów najwyższego ryzyka, czyli tych zaliczanych do klasy III. Dla wyrobów klasy IIa i IIb będzie to data 26 maja 2023 roku. Z kolei dla wyrobów klasy I – termin: 26 maja 2025 roku.
W praktyce: właśnie od wyżej wymienionych terminów Unikalna Identyfikacja Wyrobów Medycznych (UDI) musi być widoczna na poszczególnych przedmiotach. To szczególnie istotne dla producentów poszczególnych wyrobów medycznych.